A lo largo de la historia se han establecido distintos métodos que permiten conocer la estructura de un átomo. Y a su vez, permiten estudiar la configuración electrónica de cada uno de estos. El principio de exclusión de Pauli es un postulado que permite establecer reglas para entender cómo se comporta un átomo.
Este se define bajo la premisa de que dos fermiones no pueden coexistir dentro de un mismo sistema cuántico, siempre que estos dos posean el mismo número cuántico. Principalmente, este principio se ha enfocado para dar una explicación con respecto a la estructura atómica. Es de esta manera que se consideró en algún tiempo como herramienta para establecer la organización de la tabla periódica.
Es mediante su enunciado que se puede entender más a fondo de qué se trata el mundo cuántico. Fue una idea de Wolfgang Ernst Pauli, quien lo expuso al mundo en 1925. Se ha comprobado que ha tenido gran utilidad dentro de ciencias como la física y la química, pero ha tenido cavidad y utilidad en otras áreas.
¿Qué es el principio de exclusión de Pauli?
Cuando se habla del principio de exclusión de Pauli, se hace referencia a un método destinado al estudio de la configuración electrónica de los átomos. De esta manera, su enunciado declara que cuando dos partículas, reconocidas como fermiones, se encuentran en un mismo sistema cuántico, ambas deben poseer diferentes números cuánticos. En el caso de que sean iguales, estos no podrán coexistir.
Otra manera de explicar esta definición, es afirmando que dos electrones pertenecientes a un átomo no pueden tener el mismo número cuántico. Es la manera en que se podría explicar el hecho de que los electrones se encuentran distribuidos en un átomo en capas. Mientras mayor sea el número de electrones que posee un átomo, será mayor el número de capas, por lo que se considera grande en sentido del espacio que ocupa.
Esta teoría solo es aplicable a los fermiones. En este caso, se tiene que estas partículas son loa electrones, protones y neutrones que integran la estructura de un átomo. En lo que refiere a la exclusión de Pauli, también se toma en cuenta que este enunciado ha permitido dar respuestas a muchas interrogantes de la naturaleza.
El principio de Aufbau
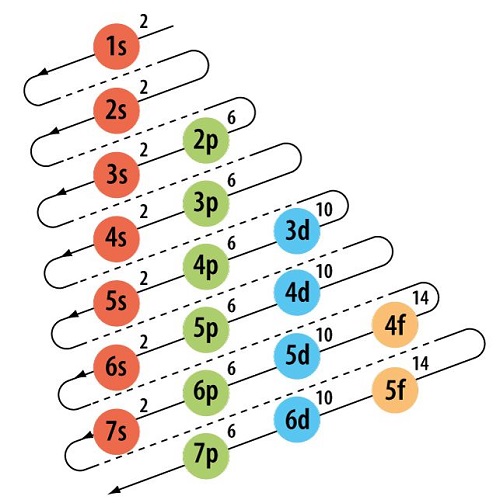
El principio de exclusión de Pauli sirve como una base para la aplicación del principio de Aufbau. Este último postulado establece pautas para la predecir la ubicación de los electrones de un átomo en distintas capas. Esto permitirá mantener el equilibro de larga electrónica del elemento. Otro nombre por el que se le ha conocido es como la regla del serrucho, debido a que se dibujan líneas diagonales, las cuales representan la configuración electrónica del átomo.
La manera en que se van colocando lo electrones es colocando primero aquellos que poseen menor energía, ya partir de aquí van aumentando. Pero la razón de que el método de Aufbau se relaciona con la exclusión de Pauli, es que ha sido tomado como una regla para poder aplicar el primer principio. En tal sentido, tomando en cuenta el enunciado de Pauli, se tiene que dos electrones no deben poseer los mismos números cuánticos. No es posible que existan electrones con una misma configuración de espines.
La regla de Hund
Igualmente, la regla de Hund ha utilizado las bases del principio de exclusión de Pauli para poder establecer la teoría de los números cuánticos. Esta se encuentra dirigida al estudio de los orbitales de un átomo. Y establece un conjunto de instrucciones que permiten ir llenando cada uno de estos.
La primera premisa declara que solo existe una manera en que un orbital posea dos direcciones de giro. En este caso, se establece que los números cuánticos magnéticos de la subcapa deben tener un mínimo de uno. Y el proceso de ubicación de electrones se inicia por aquel cuyo nivel de energía sea menor.
Se inicia desde el orbital 1s, y esto se logra al tomar como referencia número cuántico l. Ya realizada la distribución, se pasa al orbital 2s. Estos dos orbitales se destacan por solo aceptar un máximo de dos electrones. Cuando se han colocado la cantidad exacta de electrones, entonces toca llenar la siguiente capa.
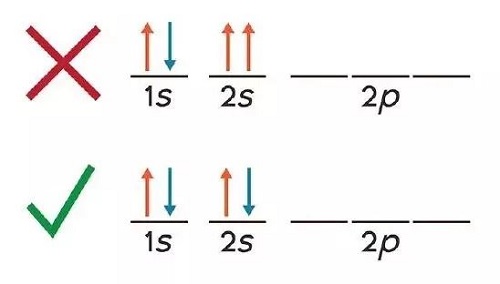
Para el caso del 2p, se trata de una capa que contiene un total de tres orbitales. Esto permite que sea posible colocar hasta seis electrones, siendo un máximo de dos por orbital. Aquí se establece una regla que declara que antes de colocar dos electrones, es necesario que en todos los orbitales exista ya por lo menos uno. De esta manera se irá realizando la distribución a lo largo de la tabla.
Tomando en cuenta la teoría establecida en el principio de exclusión de Pauli, se declara que los orbitales tendrán el mismo nivel de energía siempre que tengan el mismo número cuántico l y el mismo número cuántico m. Con el llenado de la tabla, se evidencia que por lo general está presente un mayor número de electrones desapareados.
Aplicación del principio de exclusión de Pauli
El principio de exclusión de Pauli ha influido mucho en lo que se refiere a la resolución de incógnitas en torno a los fenómenos físicos. Esto ha permitido que haya sido de gran utilidad para determinar la configuración electrónica de los átomos. Y es responsable de explicar lo que se refiere el término de estabilidad de la materia.
En este último caso, se explica que una molécula no es capaz de acercarse a otra de manera arbitraria, ya que esta se ve influenciada por la acción de los electrones. Es aquí donde se detalla el hecho de que un electrón ubicado en una molécula, no puede entrar en un estado similar al de otro electrón que se encuentra en otra molécula.
Una manera de poder explicar el efecto del principio de exclusión de Pauli, es a través del ferromagnetismo. Al existir una energía de intercambio, esto permite que los electrones de uno se alineen de manera paralela en relación con los electrones vecinos.