El Principio de máxima multiplicidad, también conocida como la Regla de Hund, es una doctrina que establece la configuración electrónica de energía más baja. También trata el estado fundamental de la energía, en cualquier subshell de electrones.
Dicho principio tiene estrecha relación de Aufbau, la cual nos dice que los orbitales que tengan menor energía, se llenarán primero de electrones. Después de que cada uno de los electrones se llene de menor energía en los orbitales correspondientes, entonces los electrones conseguirán una mayor energía.
Sin embargo, aunque este principio explica muchas cosas interesantes sobre los electrones, los científicos pronto descubrieron que existía un problema con la regla en general. Y es que no informaba o no daba la explicación concreta sobre los tres orbitales 2p y el orden en que estos se completaban.
Ahí es donde surge la regla de Hund, donde conocemos la doble ocupación de cualquier orbital y el subnivel donde está ocupado individualmente. De igual forma, mediante el Principio de máxima multiplicidad se conoció que para poder maximizar el giro total, todos los electrones que se encuentran en un solo orbital de ocupación, han de tener el mismo giro.
El Principio de máxima multiplicidad es una de las doctrinas más importantes que explican el comportamiento de los electrones y se suele usar en muchos campos de la química. Por tanto, a continuación, hablaremos en detalle sobre la Regla de Hund, cuál es su aplicación, en qué se relaciona con los electrones y un ejemplo para poder visualizarlo mejor. ¿Quieres saber más? ¡Acompáñanos hasta el final del artículo! ¡Comencemos!
¿Qué es el Principio de máxima multiplicidad?
El Principio de máxima multiplicidad no es más que una regla que explica la configuración de los electrones dadas en un término con multiplicidad correspondiente. También conocida en el mundo de la química como la Regla de Hund, padre de este precepto, se conoce que cuando los electrones en una configuración establecida, siempre tenderá a caer más bajo en energía.
Gracias a lo establecido por este principio podemos conocer y estudiar correctamente el emparejamiento de los electrones que orbitan en p. Mientras que deja a entrever que tanto p, d y f, no pueden ocurrir hasta que cada uno de los orbitales de una subshell establecida almacena un electrón o esté ocupado individualmente.
¿Quién inventó el Principio de máxima multiplicidad?
La regla de Hund de multiplicidad máxima fue descubierta por Friedrich Hund, del cual recibe su nombre, en el año 1925. Es un principio que al analizarlo requiere de mucha observación de los espectros atómicos, lo que es útil para poder predecir el estado fundamental de una molécula o un átomo con una o más capas electrónicas abiertas.

¿Qué afirma la Regla de Hund?
A través del estudio de la Regla de Hund podemos afirmar primero que, en un subnivel, cada orbital está ocupado individualmente antes de estar doblemente ocupado. Y, segundo, que los electrones presentes en cada uno de los orbitales tendrán un giro idéntico por posición propia.
¿Cómo funciona el Principio de máxima multiplicidad?
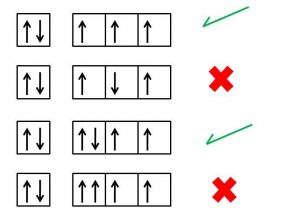
De acuerdo a la regla de Hund, los electrones siempre entrarán en una órbita vacía antes de emparejarse. Si existen dos orbitas y dos electrones, entonces cada uno agarrará una dirección distinta hasta que no se encuentren más lugares vacíos y tengan que juntarse.
Lo anterior porque los electrones poseen carga negativa, y como se repelen, no se juntarán hasta que no queden orbitales vacíos donde repelerse. Los electrones de por sí tienden a minimizar la repulsión al ocupar sus propios orbitales, en lugar de compartir un orbital con otro electrón.
Además, cuando se emplea cálculos de mecánica cuántica han demostrado que los electrones en los orbitales ocupados individualmente se seleccionan o protegen el núcleo con menos eficacia.
Explicación del Principio de máxima multiplicidad
Cuando existan dos o más grupos de orbitales degenerados, es decir, contengan la misma energía, un electrón entrará en cada uno hasta que todos estén medio llenos antes de emparejarse. Dicho principio es muy conocido, por lo que es posible que lo haya escuchado esto en relación con analogía de llenar asientos en un autobús. Donde cada persona encontrará un sitio individual en cada sitio de autobús y solo cuando estén medio llenos es que las personas se sentarán juntas.
En el caso de la segunda regla conocida relacionada con Hund, encontramos que los giros de los electrones no apareados en orbitales ocupados individualmente son los mismos. El giro inicial de los electrones en un subnivel correspondiente se decide cuál sería el giro de los electrones.
Usos del Principio de máxima multiplicidad
Por lo general, el uso de la regla de Hund depende del área que se quiera investigar los electrones, pero la química es la principal rama donde se aplica. Se utiliza principalmente en la química atómica, química cuántica y la espectroscopia.
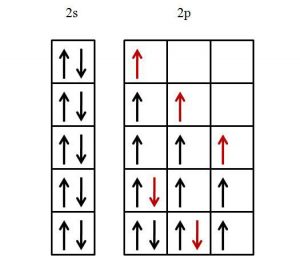
Principios relacionados con la Regla de Hund
Principio de Aufabau
Esta doctrina establece que los orbitales que contengan una menor energía, se llenarán antes que los de mayor energía. Se relaciona directamente con el Principio de máxima multiplicidad ya que así se explica por qué los electrones van primero ciertos grupos orbitales antes que otros.
Principio de exclusión de Pauli
Por otro lado, la doctrina de exclusión indica que no se pueden identificar dos electrones por el mismo conjunto de números cuánticos. Lo anterior sucede porque dos electrones dentro del mismo orbital tendrán conjuntos únicos de números cuánticos.
Ambos principios, junto a la regla de Hund, permiten hacer mucho trabajo con la configuración de los electrones, su comportamiento y los diagramas de energía. Es posible que la relación no se vea directamente, pero a medida que se trabaja con la regla verá que es necesario la ampliación de ambas leyes en la búsqueda de resultados concretos.
Ejemplo del Principio de máxima multiplicidad
Para poder ver mejor el funcionamiento del principio, se puede considerar las diferentes formas en que un par de electrones trabajan en un orbital. Los electrones se acomodarán en el mismo orbital mediante aumente la repulsión electrostática entre los electrones en promedio mientras están más juntos. Mientras que los electrones con espines opuestos, tienden acercarse entre sí que si los espines fuesen paralelos.