Como en algunos de los más grandes sucesos en el mundo, el análisis empírico atrayendo grandes resultados a la ciencia como en el caso del principio de maxima multiplicidad de hund.
El principio de máxima multiplicidad plantea llenar orbitales vacíos de los electrones y así éstos queden unidos como un enlace covalente polar para formar un compuesto o masa lleno de energía.
La multiplicidad que fundamenta a este principio se demuestra al encontrarse la cualidad de múltiples o excesivos electrones en los orbitales.
Principio de maxima multiplicidad de hund
La Regla de Hund, llevada a los predios científicos y académicos en 1927, se basa en la siguiente afirmación:
Cuando los electrones se ordenan en los orbitales su ubicación siempre será paralela, es decir, se encuentran desapareados.
Al estar llenos todos los orbitales con el mismo spin procede a darse un apareamiento de electrones (para así distribuir la carga y mantener la neutralidad del átomo).
En varios tratados universitarios, en especial a los relacionados a la química que se procura en el estudio y aplicación de la energía nuclear, se dice que:
Si dos o más electrones de un mismo átomo tienen los mismos valores en sus números cuánticos principales ( n ) y en sus números cuánticos secundarios ( l ) , entonces tendrán iguales valores de spin ( s ) siempre y cuando no se trasgreda el principio de exclusión (de Pauli).
En química cuántica la aplicabilidad del principio de maxima multiplicidad de hund estipula: cuando en el nivel más alto hay varios orbitales con la misma energía (degenerados), el alineamiento del spin de los electrones desapareados es ferromagnético.
Con esto se explica el paramagnetismo del dioxígeno y de los cationes de muchos metales de transición, como el cobre, plata, oro o zinc.
 Comprensión del principio de maxima multiplicidad de hund
Comprensión del principio de maxima multiplicidad de hund
El mismo nació de una construcción o reconstrucción empírica de los espectros atómicos.
La regla o principio de máxima multiplicidad de hund se comprende al observar que todos los orbitales en una subcapa han de estar ocupados por lo menos por un electrón antes de que se le asigne un segundo.
Ergo, todos los orbitales deben estar llenos y todos los electrones en paralelo antes de que un orbital gane un segundo electrón.
Y cuando un orbital gana un segundo electrón, éste deberá estar apareado del primero (espines opuestos o anti paralelos).
Fórmula y ejemplo
El principio de maxima multiplicidad de hund establece que cuando en un subnivel existen varios orbitales (por ejemplo, en el subnivel l =1, existen los orbitales px, py y pz) y así en primer lugar se semi ocupan todos los orbitales para después completarlos emparejando los spines de los electrones
Es destacable debido a que las propiedades químicas de los átomos dependen fundamentalmente de la estructura electrónica más externa y el que pueda haber en ella orbitales con electrones desapareados debe tenerse en cuenta de forma muy especial.
Ejemplo: La estructura del O (oxígeno) conviene expresarla: 1s2 2s2 2px2 2py1 2pz1;
De esta manera se está indicando la existencia de 2 orbitales externos con electrones desapareados.
Este principio de maxima multiplicidad de hund indica que para orbitales de igual energía, la distribución más estable de los electrones es aquella que tenga mayor número de espines paralelos.
Aclarando: éstos son electrones desapareados.
Esto significa que los electrones se ubican uno en uno (con el mismo spin) en cada orbital y luego se completan con el segundo electrón con spin opuesto.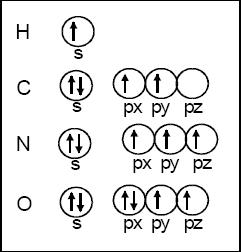
El principio de Aufbau
Para la correcta aplicación del principio de maxima multiplicidad de hund, se debe interconectar con otras guías de la química básica.
La más utilizada es el principio de Aufbau (en alemán, construir), por ser una guía útil para predecir teóricamente la configuración electrónica de un elemento.
Fue concebido en sus reglas elementales con el propósito de ayudar a construir el átomo.
La hipotética construcción atómica, se refiere exclusivamente a los electrones, los cuales a su vez van de la mano del creciente número de protones.
Los protones definen el número atómico Z de un elemento químico y por cada uno agregado al núcleo se adiciona un electrón para compensar este incremento de la carga positiva.
El principio de maxima multiplicidad de hund y el principio de Aufbau
Hemos hecho énfasis que en el principio de maxima multiplicidad de hund la distribución más estable de electrones en los subniveles es aquella que tenga el mayor número de espines paralelos.
Al realizarse el llenado electrónico, primero se llena el orbital «s» y se continúa con el siguiente orbital del mismo nivel.
Los electrones se acomodan de uno en uno hasta llenar todos los espacios de ese orbital, colocando el electrón con el mismo spin (flecha hacia arriba) y se regresa con el primer espacio colocando la flecha en sentido contrario para empezar a llenar en el mismo orden todos los espacios.
En un mismo orbital pueden quedar espacios vacíos o espacios semillenos.
Para poder aplicar bien la regla de Hund, es necesario saber que todos los orbitales en una capa deben de encontrarse ocupados al menos por un electrón antes de que se añada un segundo electrón.
Es decir, los orbitales deben estar completos y todos los electrones deben encontrarse en paralelo antes de que el orbital se llene del todo.
Cuando el orbital adquiera el segundo electrón, éste debe encontrarse apareado con el anterior.
 De esta manera, los electrones de un átomo van añadiéndose de manera progresiva, utilizando una configuración ordenada, con la finalidad de tener buenas condiciones energéticas estables.
De esta manera, los electrones de un átomo van añadiéndose de manera progresiva, utilizando una configuración ordenada, con la finalidad de tener buenas condiciones energéticas estables.
Así el principio de Aufbau, explica bien las reglas a seguir para el llenado de orbitales para no utilizar mal la regla de Hund. En resumen, como existen orbitales equivalentes, primeramente se completan los electrones al máximo que se pueda y posteriormente se pasa a emparejar.
Aplicaciones adicionales del principio de maxima multiplicidad de hund
El principio de máxima multiplicidad de hund es aplicable a la hora de hacer diagramas de orbitales.
El mismo nos aclara que es correcto colocar un electrón en cada orbital de valencia y luego rellenarlos con otro con spin opuesto en cada uno, ya que ésa es la mejor manera de minimizar las repulsiones según la teoría cuántica.
A menudo se suele representar los orbitales a través de un cuadro rectangular, usando flechas hacia arriba o hacia abajo, para designar los electrones con números cuánticos magnéticos de spin con valores +1/2 o -1/2, respectivamente.
Papel fundamental de los electrones
La configuración más estable es la que los electrones se encuentran ocupando orbitales distintos, y con spines que estén orientados paralelamente.
La ocupación, u semiocupación de los orbitales se puede comprender de manera sencilla, pues la repulsión electrostática entre los electrones es ínfima.
Por la preferencia por los spines paralelos, se pueden ver justificados solamente sobre la base de un tratamiento de la mecánica ondulatoria.
El principio de maxima multiplicidad de hund se basa en el hecho de que los electrones se repelen uno al otro.
Al ocupar diferentes orbitales, los electrones permanecen tan alejados uno de otro, como es posible, minimizando las repulsiones.